Formaldehyde là một trong những hóa chất công nghiệp được sử dụng rộng rãi trong nhiều lĩnh vực như sản xuất nhựa, vật liệu xây dựng, dệt may, y tế và mỹ phẩm. Tuy nhiên, đây cũng là một hóa chất có độc tính cao, đòi hỏi phải hiểu rõ về đặc tính và sử dụng đúng cách để đảm bảo an toàn.
Mục lục bài viết
- 1 ✅ 1. Formaldehyde là gì?
- 2 🧪 2. Tính chất hóa học nổi bật của Formaldehyde
- 3 🏭 3. Ứng dụng của Formaldehyde trong công nghiệp
- 4 ⚠️ 4. Mức độ độc hại và cảnh báo an toàn
- 5 🛡️ 5. Hướng dẫn an toàn khi sử dụng Formaldehyde
- 6 📦 Cung cấp Formaldehyde – Hóa chất công nghiệp uy tín
- 7 ✅ Kết luận
- 8 Chất phụ gia chống oxy hóa trong thực phẩm
- 9 Top 5 Công Ty Dầu Nhớt Uy Tín Tại Biên Hòa Đồng Nai
- 10 Phân biệt hóa chất tinh khiết và hóa chất công nghiệp
- 11 Tổng hợp những hóa chất sát trùng chuồng trại hiệu quả nhất hiện nay
✅ 1. Formaldehyde là gì?
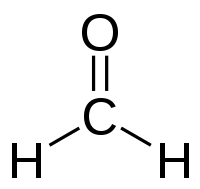
Formaldehyde (tên gọi khác: Methanal) là một hợp chất hữu cơ đơn giản, có công thức hóa học là HCHO.
-
Dạng tồn tại: Khí không màu, có mùi hăng mạnh.
-
Dung dịch phổ biến: Formol (37–40%), thường pha trong nước và methanol để ổn định.
-
Khối lượng phân tử: 30.03 g/mol
-
Điểm sôi: -19°C (dạng khí), 96°C (dung dịch formol)
-
Tính chất: Dễ bay hơi, dễ cháy, tan tốt trong nước, ethanol và ether.
🧪 2. Tính chất hóa học nổi bật của Formaldehyde
-
Có khả năng phản ứng với amine, phenol, protein → tạo polymer hoặc liên kết chéo.
-
Dễ bị oxy hóa thành axit formic.
-
Tham gia phản ứng ngưng tụ với các hợp chất hữu cơ khác → ứng dụng trong sản xuất nhựa.
🏭 3. Ứng dụng của Formaldehyde trong công nghiệp
🔹 3.1. Sản xuất nhựa và vật liệu xây dựng
-
Là nguyên liệu chính trong sản xuất nhựa urê-formaldehyde, phenol-formaldehyde và melamine-formaldehyde → dùng làm keo dán gỗ, ván ép, ván MDF.
-
Ứng dụng trong sản xuất sơn, chất phủ, keo dán.
🔹 3.2. Ngành dệt may
-
Dùng để xử lý vải chống nhăn, chống co rút.
-
Có mặt trong các loại chất hoàn tất vải.
🔹 3.3. Y tế – Dược phẩm
-
Dung dịch formol dùng để bảo quản mô, xác, mẫu vật.
-
Làm chất khử trùng trong bệnh viện, phòng thí nghiệm.
-
Sử dụng trong sản xuất vaccine, thuốc sát trùng da (trong nồng độ cho phép).
🔹 3.4. Nông nghiệp và thủy sản
-
Được dùng trong quá khứ để khử trùng ao nuôi, sát trùng trứng cá, tuy nhiên hiện nay đã bị hạn chế do tính độc cao.
⚠️ 4. Mức độ độc hại và cảnh báo an toàn
Formaldehyde được Tổ chức Y tế Thế giới (WHO) xếp vào nhóm chất có thể gây ung thư ở người (nhóm 1).
❗ Những nguy cơ khi tiếp xúc với Formaldehyde:
| Đường tiếp xúc | Tác hại |
|---|---|
| Hít phải | Gây kích ứng mũi, họng, khó thở, ho. Tiếp xúc lâu dài có nguy cơ ung thư phổi, xoang. |
| Tiếp xúc da | Gây viêm da tiếp xúc, nổi mẩn, ngứa. |
| Tiếp xúc mắt | Làm cay mắt, chảy nước mắt, tổn thương giác mạc. |
| Nuốt phải | Gây đau bụng, buồn nôn, nguy hiểm tính mạng. |
🛡️ 5. Hướng dẫn an toàn khi sử dụng Formaldehyde
-
Sử dụng nơi thông thoáng, có hệ thống hút khí tốt.
-
Đeo đầy đủ bảo hộ: khẩu trang chống hóa chất, kính, găng tay, áo choàng.
-
Không để gần nguồn nhiệt, lửa vì dễ cháy.
-
Bảo quản trong thùng kín, có nhãn cảnh báo rõ ràng, tránh ánh sáng trực tiếp.
👉 Khi có sự cố tràn, cần dùng than hoạt tính hoặc khăn hút chuyên dụng, tuyệt đối không rửa bằng nước lan rộng.
📦 Cung cấp Formaldehyde – Hóa chất công nghiệp uy tín
CÔNG TY TNHH HÓA CHẤT THUẬN NAM chuyên phân phối Formaldehyde (Formol 37–40%) phục vụ các ngành:
-
Nhựa – Sơn – Keo công nghiệp
-
Gỗ – Dệt may – Phòng thí nghiệm
-
Bảo quản y tế – Mẫu sinh học
✔️ Hàng chuẩn hóa, xuất xứ rõ ràng
✔️ Giao hàng toàn quốc – Có CO, CQ
✔️ Tư vấn an toàn sử dụng và vận chuyển
📍 Địa chỉ: 1/11D, Tổ 8B, KP3, Trảng Dài, Biên Hòa, Đồng Nai
📞 Hotline/Zalo: 0938 414 118
📩 Email: thunaco@gmail.com
🌐 Website: https://hoachatthuannam.com
✅ Kết luận
Formaldehyde là hóa chất có giá trị cao trong công nghiệp, nhưng cũng ẩn chứa nhiều nguy cơ độc hại nếu sử dụng sai cách. Việc nắm rõ thông tin cơ bản, cách sử dụng và bảo quản Formaldehyde sẽ giúp người dùng đảm bảo hiệu quả và an toàn lao động trong quá trình sản xuất.
| Formaldehyd | |
|---|---|
|
|
|
| Tổng quan | |
| Danh pháp IUPAC | Methanal |
| Tên khác | mêtylen ôxít mêtyl anđêhít foocmôn, foocmalin |
| Công thức phân tử | CH2O |
| Phân tử gam | 30,03 g/mol |
| Biểu hiện | Chất khí không màu mùi hăng mạnh |
| Số CAS | [50-00-0] |
| Thuộc tính | |
| Tỷ trọng và pha | 1 g/m3, khí |
| Độ hòa tan trong nước | > 100 g/100 ml (20 °C) |
| Điểm nóng chảy | -117 °C (156 K) |
| Điểm sôi | -19.3 °C (253.9 K) |
| pKa | |
| pKb | |
| Độ nhớt | ? cP ở 20 °C |
| Nguy hiểm | |
| MSDS | MSDS ngoài |
| Các nguy hiểm chính | Chất độc, dễ cháy |
| NFPA 704 | |
| Điểm bắt lửa | -53 °C |
| Rủi ro/An toàn | R: 23/24/25, 34, 40, 43 S: 1/2, 26, 36/37,39, 45, 51 |
| Số RTECS | LP8925000 |
| Trang dữ liệu bổ sung | |
| Cấu trúc & thuộc tính | n εr, v.v. |
| Dữ liệu nhiệt động lực | Các trạng thái rắn, lỏng, khí |
| Dữ liệu quang phổ | UV, IR, NMR, MS |
| Các hợp chất liên quan | |
| Các hợp chất tương tự | axêtalđêhít benzalđêhít |
| Các hợp chất liên quan | Xêtôn axít cacboxylic |
| Ngoại trừ có thông báo khác, các dữ liệu được lấy ở 25°C, 100 kPa Thông tin về sự phủ nhận và tham chiếu |
|