1. LƯU HUỲNH LÀ GÌ ?
Lưu huỳnh còn có tên gọi khác là Sulfur, là một nguyên tố hoá học trong bảng tuần hoàn, có ký hiệu là S và có số nguyên tử là 16.
Nguyên tố này là một phi kim phổ biến, không mùi, không vị và có nhiều hoá trị.
Dạng gốc của phi kim này là chất rắn kết tinh màu vàng chanh.
Trong tự nhiên, phi kim này có thể tìm thấy ở dạng đơn chất hoặc trong các khoáng chất sulfua và sulfat.
Lưu huỳnh được xem là một nguyên tố thiết yếu cho sự sống và chúng được tìm thấy trong 2 axit amin. Trong thương mại, chúng được sử dụng trong phân bón hoặc dùng trong thuốc súng, diêm, thuốc trừ sâu và thuốc diệt nấm,..
Vị trí: Ô thứ 16, chu kì 3, nhóm VIA
Kí hiệu: 3216S1632S
Cấu hình e: 1s22s22p63s23p41s22s22p63s23p4
Độ âm điện: 2,58
2. ĐẶC TÍNH CỦA LƯU HUỲNH
– Ở điều kiện nhiệt độ phòng, lưu huỳnh ở trạng thái rắn xốp và có màu vàng nhạt và ở trạng thái đơn chất không có mùi. Phi kim này khi cháy có ngọn lửa màu xanh lam và toả ra đioxit lưu huỳnh có mùi ngột ngạt, khác thường và tạo cảm giác khó chịu. Sulfur không hòa tan trong nước nhưng hòa tan trong đisulfua cacbon và các dung môi không phân cực khác. Một số trạng thái ôxi hóa phổ biến của Sulfur là -2, -1(pirit sắt…), +2, +4 và +6. Sulfur tạo thành các hợp chất ổn định với gần như mọi nguyên tố, chỉ ngoại trừ các khí trơ.
– Ở trạng thái rắn, Sulfur tồn tại như các phân tử vòng dạng vòng hoa S8 và bên cạnh đó nó cũng có nhiều hình thù khác. Màu vàng đặc trưng của lưu huỳnh được tạo nên từ việc loại một nguyên tử từ vòng S7. Ngược lại, nguyên tố oxy cùng phân nhóm nhưng lại nhẹ hơn về cơ bản chỉ tổn tại trong 2 dạng là: O2 và O3
– Sulfur có tinh thể rất phức tạp, phục thuộc vào các điều kiện cụ thể, các thù hình của chúng tạo thành các cấu trúc tinh thể khác nhau, các dạng hình thoi và xiên đơn S8 là các dạng được nghiên cứu tỉ mỉ nhất.
– Sulfur nóng chảy có độ nhớt, đây cũng là tính chất nổi bật của phi kim này, độ nhớt này tăng lên theo nhiệt độ do sự hình thành các chuỗi polyme. Tuy nhiên, sau khi đã đạt được một khoảng nhiệt độ nhất định thì độ nhớt lại bị giảm do đã đủ năng lượng để phá vỡ chuỗi polymer.
– Sulfur vô định hình hay còn gọi là “dẻo” có thể tạo ra khi làm nguội nhanh Sulfur nóng chảy. Theo nghiên cứu tinh thể bằng tia X, dạng vô định hình có thể có cấu trúc xoắn ốc với 8 nguyên tử trên một vòng. Đây là dạng ổn định ở nhiệt độ phòng và dần chuyển thành dạng kết tinh. Quá trình này diễn ra trong vài giờ hoặc vài ngày nhưng có thể tăng tốc nếu có xúc tác.
3.TÍNH CHẤT CỦA LƯU HUỲNH
a. Tính chất vật lý
Dạng thù hình:
– Lưu huỳnh tà phương: SαSα
– Lưu huỳnh đơn tà: SβSβ
Hai dạng này khác nhau về cấu tạo tinh thể cùng một số tính chất vật lý nhưng có tính chất hoá học giống nhau. Hai dạng này có thể biến đổi qua lại với nhau tuỳ theo điều kiện nhiệt độ.
Ảnh hưởng của nhiệt độ tới tính chất vật lý:
– Ở nhiệt độ <113 độ C Sα và Sβ là chất rắn màu vàng, phân tử có 88 nguyên tử liên kết cộng hóa trị với nhau tạo mạch vòng.
– Ở nhiệt độ =119 độ C Sα và Sβ nóng chảy thành chất lỏng màu vàng, rất linh động.
– Ở nhiệt độ =187 độ C, lưu huỳnh lỏng trở nên quánh nhớt, có màu nâu đỏ.
– Ở nhiệt độ =445 độ C, lưu huỳnh sôi.
b. Tính chất hoá học
Nguyên tử S có 6e lớp ngoài cùng, trong đó có 2e độc thân.
Trong phản ứng hoá học thì số oxi hóa của lưu huỳnh có thể giảm hoặc tăng: −2; 0; +4; +6.
Tính oxi hoá
Khi tác dụng với các kim loại hoặc hidro, số oxi hoá của Sulfur giảm từ 0 xuống -2.
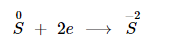
Khi tác dụng với kim loại: Sulfur tác tụng với kim loại tạo thành muối Sunfua.
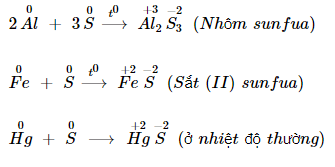
Khi tác dụng với hydro tạo thành khí hiđro sunfua.
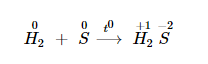
Tính khử
Lưu huỳnh tác dụng với phi kim hoạt động mạnh hơn, số oxi hoá tăng lên từ 0 lên +4 hoặc +6.
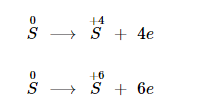
Lưu huỳnh phản ứng với phi kim khi ở nhiệt độ thích hợp.
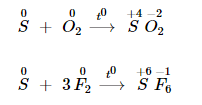
Tác dụng với chất oxi hoá mạnh.
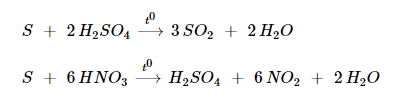
4.ỨNG DỤNG CỦA LƯU HUỲNH
Lưu huỳnh được dùng nhiều trong công nghiệp với các ứng dụng khác nhau. Sulfur có dẫn xuất chính là axít sulfuric (H2SO4), được đánh giá là một trong những nguyên tố quan trọng nhất được dùng như nguyên liệu công nghiệp và được xem là quan trọng bậc nhất với mọi lĩnh vực của kinh tế thế giới.
Một số ứng dụng chủ yếu của lưu huỳnh:
– Sản xuất axit sulfuric.
– Sử dụng trong ắc quy, bột giặt, lưu hoá cao su, thuốc diệt nấm và dùng trong sản xuất phân bóng phốtphat.
– Sulfit được sử dụng để làm trắng giấy và làm chất bảo quản trong rượu vang và làm khô hoa quả.
– Với bản chất dễ cháy, nó còn được dùng trong các loại diêm, thuốc súng và pháo hoa.
– Sulfat magiê (muối Epsom) có thể được dùng như thuốc nhuận tràng, chất bổ sung cho các bình ngâm (xử lý hóa học), tác nhân làm tróc vỏ cây, hay để bổ sung magiê cho cây trồng.
– Lưu huỳnh nóng chảy còn được dùng để tạo các lớp khảm trang trí trong sản phẩm đồ gỗ.
– Các axít amin cystein và methionin có chứa lưu huỳnh, cũng như mọi polypeptid, protein và enzym có chứa các axít amin này, làm cho lưu huỳnh trở thành thành phần cần thiết cho mọi tế bào.
– Các liên kết disulfua giữa các polypeptid có vai trò rất quan trọng trong sự tạo thành và cấu trúc của protein. Homocystein và taurin cũng là các axít amin chứa lưu huỳnh nhưng không được mã hóa bởi ADN và cũng không phải là một phần của cấu trúc sơ cấp của các protein.
– Một số dạng vi khuẩn sử dụng sulfua hiđrô (H2S) thay vào vị trí của nước như là chất cung cấp electron trong các tiến trình thô sơ tương tự như quang hợp.
– Thực vật cũng hấp thụ lưu huỳnh từ đất trong dạng các ion sulfat.
– Lưu huỳnh vô cơ tạo thành một phần của các cụm sắt-lưu huỳnh, và lưu huỳnh là chất cầu nối trong vị trí CuA của cytochrom c ôxidaza.
– Sulfur cũng là thành phần quan trọng của coenzym A.
5. LỊCH SỬ HÌNH THÀNH CỦA LƯU HUỲNH
Lưu huỳnh có tên tiếng Phạn là: sulvere và tiếng Latinh là: sulpur, còn được gọi là lưu hoàng, sinh diêm vàng và diêm sinh.
Trong tiếng Ả Rập sufra có nghĩa là màu vàng, có từ màu sáng của dạng tự nhiên của lưu huỳnh và được cho rằng nó là nguyên tử của các tên gọi để chỉ lưu huỳnh trong ngôn ngữ của một số quốc gia châu Âu hiện nay.
Homer đã đề cập tới “lưu huỳnh ngăn ngừa các loài phá hoại” từ thế kỷ 9 TCN và năm 424 TCN thì bộ tộc ở Boeotia đã tiêu hủy các bức tường của thành phố bằng cách đốt hỗn hợp than, lưu huỳnh và hắc ín dưới chân tường.
Vào khoảng thế kỷ 12, người Trung Quốc đã phát minh ra thuốc súng, là hỗn hợp của nitrat kali (KNO3), cacbon và lưu huỳnh.
Năm 1867 lưu huỳnh đã được phát hiện trong các mỏ ở Louisiana và Texas.
6. DẠNG TỒN TẠI TRONG TỰ NHIÊN
– Ở dạng đơn chất, Sulfur được tìm thấy ở gần các suối nước nóng và các khu vực núi lửa tại nhiều nơi trên thế giới, đặc biệt là dọc theo vành đai lửa Thái Bình Dương.
– Các mỏ đáng kể của lưu huỳnh đơn chất cũng tồn tại trong các mỏ muối dọc theo bờ biển thuộc vịnh Mexico và trong các evaporit ở Đông Âu và Tây Á.
– Lưu huỳnh thu được từ dầu mỏ, khí đốt và cát dầu Athabasca đã trở thành nguồn cung cấp lớn trên thị trường, với các kho dự trữ lớn dọc theo Alberta.
– Các hợp chất chứa lưu huỳnh nguồn gốc tự nhiên phổ biến nhất là các sulfua kim loại, như pyrit (sulfua sắt), cinnabar hay chu sa (sulfua thủy ngân), galen (sulfua chì), sphalerit (sulfua kẽm) và stibnit (sulfua antimon) cũng như các sulfat kim loại, như thạch cao (sulfat canxi), alunit (sulfat nhôm kali) và barit (sulfat bari).
7.HỢP CHẤT CỦA LƯU HUỲNH
Hợp chất của lưu huỳnh là Sulfua Hydro, có mùi trứng thối đặc trưng, khi hoà tan trong nước thì có tính axit và phản ứng với nhiều kim loại để tạo ra các sulfua kim loại.
Sulfua kim loại khá phổ biến, phổ biến nhất là của sắt, sulfua của sắt còn được gọi là pyrit.
Lưu huỳnh còn có nhiều hợp chất khác như êtyl và mêtyl mecaptan có mùi khó ngửi và được dùng làm chất tạo mùi cho khí đốt nhằm dễ dàng phát hiện rò rỉ.
Nitrua lưu huỳnh polyme hóa có các tính chất của kim loại mặc dù chúng không chứa bất kỳ một nguyên tử kim loại nào. Chúng có các tính chất điện và quang học bất thường và polyme này có thể tạo ra từ têtranitrua têtra lưu huỳnh S4N4.
Những hợp chất quan trọng khác của lưu huỳnh
Hợp chất vô cơ
Một số hợp chất vô cơ của lưu huỳnh là:
– Sulfua (S2-)
– Sulfit (SO32-), các muối của axít sulfurơ, H2SO3, axít sulfurơ và các sulfit tương ứng, ion pyrosulfit hay mêtabisulfit (S2O52−).
– Sulfat (SO42-), các muối của axít sulfuric.
– Thiôsulfat (đôi khi được gọi là thiôsulfit hay “hyposulfit”) (S2O32−)- như thiôsulfat natri.
– Đithiônit natri, Na2S2O4 tạo ra từ axít hyposulfurơ/đithiônơ –
– Đithiônat natri (Na2S2O6)
– Axít polythiônic (H2SnO6)
– Axít perôxymônôsulfuric (H2SO5) và axít perôxyđisulfuric (H2S2O8)-
– Polisulfua natri (Na2Sx)
– Hexaflorua lưu huỳnh, SF6
– Têtranitrua têtra lưu huỳnh S4N4
Hợp chất hữu cơ
Một số hợp chất hữu cơ:
– Dimêtyl sulfôniôprôpiônat (DMSP; (CH3 )2S+CH2CH2COO-)
– Thiol (hay mecaptan)
– Thiolat
– Sulfôxít
– Sulfon
– Thuốc thử Lawesson
– Naptalen-1,8-điyl 1,3,2,4-đithiađiphốtphetan 2,4-đisulfua
Đồng vị
– Lưu huỳnh có 18 đồng vị trong đó có 4 đồng vị ổn định: S32 (95,02%), S33 (0,75%), S34 (4,21%) và S36 (0,02%).
Lưu ý với các hợp chất của lưu huỳnh
Cần cẩn thận khi tiếp xúc với: đisulfua cacbon, ôxysulfua cacbon, sulfua hiđrô và điôxít lưu huỳnh.
– Đioxit lưu huỳnh an toàn khi sử dụng như phụ gia thực phẩm với 1 lượng nhỏ nhưng ở nồng độ cao độ phản ứng với hơi ẩm để tạo ra axít sulfurơ đủ lớn thì sẽ gây tổn thương cho phổi, mắt và các cơ quan khác.
– Sulfua hiđrô rất độc, độc hơn cả xyanua.
8. SẢN XUẤT LƯU HUỲNH
Lưu huỳnh được sản xuất chủ yếu theo 2 phương pháp sau:
Phương pháp vật lý:
– Khai thác dưới dạng tự do trong lòng đất.
– Dùng hệ thống nén nước siêu nóng (170 độ C) cho vào mỏ lưu huỳnh để đẩy lưu huỳnh nóng chảy lên trên mặt đất.
Phương pháp hoá học:
– Đốt H2S trong điều kiện thiếu không khí.
![]()
– Dùng H2S khử SO2.
![]()
9. ẢNH HƯỞNG VỚI MÔI TRƯỜNG
Than và dầu mỏ trong công nghiệp khi đốt cháy cùng các nhà máy điện giải phóng ra lượng lớn đioxit lưu huỳnh SO2, chất này phản ứng với hơi nước và oxy có trong khi quyển tạo ra axít sulfuric tạo nên các cơn mưa axit làm giảm pH của đất, các khu vực nước ngọt, gây phong hoá hoá học với các công trình xây dựng hoặc kiến trúc.
