Sulfuric Acid 98% | H2SO4 | Axit sunphuric
1. Sulfuric Acid là gì?
Sulfuric Acid (H₂SO₄), hay còn gọi là axit sunfuric, là một trong những hóa chất công nghiệp quan trọng nhất. Đây là một axit mạnh, có khả năng ăn mòn cao và được ứng dụng rộng rãi trong nhiều ngành công nghiệp như sản xuất phân bón, luyện kim, xử lý nước và sản xuất hóa chất.
2. Tính chất lý hóa của Sulfuric Acid
- Công thức hóa học: H₂SO₄
- Khối lượng phân tử: 98.08 g/mol
- Trạng thái: Chất lỏng nhớt, không màu đến hơi vàng
- Tính tan: Tan hoàn toàn trong nước, tỏa nhiệt mạnh khi hòa tan
- Độ pH: <1 (axit mạnh)
- Điểm sôi: 337°C
- Điểm nóng chảy: 10°C
- Số CAS: 7664-93-9
- Mã HS Code: 28070000
3. Ứng dụng của Sulfuric Acid trong công nghiệp
3.1. Ngành sản xuất phân bón
- Thành phần chính trong sản xuất phân bón như super phosphate và ammonium sulfate.
- Cung cấp lưu huỳnh – nguyên tố thiết yếu cho cây trồng.
3.2. Ngành luyện kim
- Sử dụng trong quá trình tẩy rửa kim loại trước khi mạ kẽm hoặc mạ điện.
- Tách các tạp chất kim loại trong quá trình tinh luyện.
3.3. Ngành xử lý nước
- Điều chỉnh pH trong xử lý nước công nghiệp.
- Sử dụng trong quá trình sản xuất nhựa trao đổi ion để làm mềm nước.
3.4. Ngành sản xuất hóa chất
- Là nguyên liệu để tổng hợp nhiều hợp chất hữu cơ và vô cơ.
- Ứng dụng trong sản xuất axit nitric, hydrochloric acid và nhiều hợp chất sunfat.
3.5. Ngành dầu khí
- Dùng trong quá trình tinh chế dầu mỏ và xử lý khí.
- Ứng dụng trong sản xuất nhiên liệu và chất xúc tác.
4. Hướng dẫn sử dụng Sulfuric Acid an toàn
🔹 Cách sử dụng đúng cách
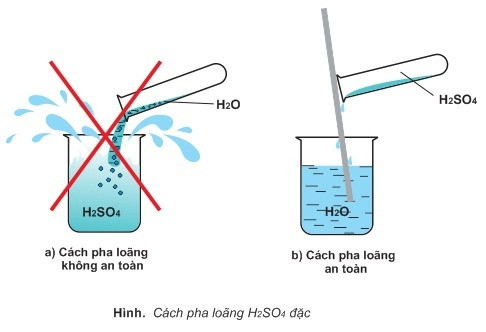
- Pha loãng axit từ từ vào nước, không làm ngược lại để tránh phản ứng nhiệt mạnh.
- Sử dụng dụng cụ bảo hộ như kính bảo hộ, găng tay chống hóa chất.
- Làm việc trong môi trường thông thoáng để tránh hít phải hơi axit.
⚠️ Lưu ý an toàn khi sử dụng
✔ Tránh tiếp xúc trực tiếp với da và mắt, có thể gây bỏng nghiêm trọng.
✔ Không đổ axit vào cống rãnh hoặc nguồn nước tự nhiên.
✔ Không để gần kim loại dễ bị ăn mòn và chất dễ cháy.
5. Hướng dẫn bảo quản
✔ Bảo quản nơi khô ráo, thoáng mát, tránh ánh nắng trực tiếp.
✔ Đựng trong thùng chứa chuyên dụng, tránh xa nguồn nhiệt.
✔ Đóng kín nắp thùng chứa để tránh bay hơi.
6. Mua Sulfuric Acid chất lượng cao ở đâu?
Công Ty TNHH Hóa Chất Thuận Nam chuyên cung cấp Axit Sunfuric chất lượng cao, giá cạnh tranh, phù hợp với nhu cầu công nghiệp.
📍 Địa chỉ: 1/11D, Tổ 8B, KP3, Trảng Dài, Biên Hòa, Đồng Nai.
📞 Hotline/Zalo: 0938 414 118
📩 Email: thunaco@gmail.com
🌐 Website: hoachatthuannam.com
Liên hệ ngay để nhận báo giá và tư vấn chi tiết về Sulfuric Acid!


Chưa có đánh giá nào.